某學(xué)習(xí)小組探究濃、稀硝酸氧化性的相對(duì)強(qiáng)弱��,按如圖裝置進(jìn)行試驗(yàn)(夾持儀器已略去)��。實(shí)驗(yàn)表明濃硝酸能將NO氧化成NO2��,而稀硝酸不能氧化NO��,由此得出的結(jié)論是濃硝酸的氧化性強(qiáng)于稀硝酸��。
可選藥品:濃硝酸��、3mol/L稀硝酸��、蒸餾水��、氫氧化鈉溶液及氮?dú)狻?br />已知:氫氧化鈉溶液不與NO反應(yīng)��,能與NO2反應(yīng):2NO2+2NaOH=NaNO3+NaNO2+H2O��。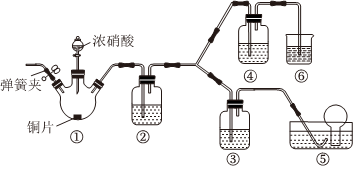
(1)實(shí)驗(yàn)應(yīng)避免有害氣體排放到空氣中��,裝置②��、③��、④��、⑤��、⑥中盛放的藥品依次是
ACBAD
ACBAD
(選填“A��、B��、C��、D”��,藥品可重復(fù)使用)��。
A.蒸餾水
B.濃硝酸
C.3mol/L稀硝酸
D.氫氧化鈉溶液
(2)滴加濃硝酸之前的操作是:檢驗(yàn)裝置的氣密性��,加入藥品��,打開(kāi)彈簧夾后��,繼續(xù)進(jìn)行的操作是 通入N2一段時(shí)間
通入N2一段時(shí)間
��,然后關(guān)閉彈簧夾��,將裝置⑤中導(dǎo)管末端伸入倒置的燒瓶?jī)?nèi)��。
(3)裝置①中發(fā)生反應(yīng)的化學(xué)方程式是 Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O
��。
(4)裝置②發(fā)生反應(yīng)的化學(xué)方程式是 3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
��。
(5)該小組得出結(jié)論依據(jù)的實(shí)驗(yàn)現(xiàn)象是 裝置③中液面上方氣體仍為無(wú)色��,裝置④中液面上方氣體由無(wú)色變?yōu)榧t棕色
裝置③中液面上方氣體仍為無(wú)色��,裝置④中液面上方氣體由無(wú)色變?yōu)榧t棕色
��。
(6)實(shí)驗(yàn)結(jié)束后��,同學(xué)們發(fā)現(xiàn)裝置①中溶液呈綠色��,而不顯藍(lán)色��。甲同學(xué)認(rèn)為是該溶液中硝酸銅的質(zhì)量分?jǐn)?shù)較高所致��,而乙同學(xué)認(rèn)為是該溶液中溶解了生成的氣體��。同學(xué)們分別設(shè)計(jì)了以下4個(gè)試驗(yàn)來(lái)判斷兩種看法是否正確��。這些方案中可行的是 abc
abc
(填字母)��。
a.加熱該綠色溶液,觀察顏色變化
b.向該綠色溶液中通入氮?dú)?�,觀察顏色變化
c.向飽和硝酸銅溶液中通入濃硝酸與銅反應(yīng)產(chǎn)生的氣體��,觀察顏色變化
d.加水稀釋綠色溶液��,觀察顏色變化


