研究化肥的合成�����、廢水的處理等有現(xiàn)實(shí)的重要意義.
(1)硝酸銨的生產(chǎn)方法是采用硝酸與氨氣化合�,工業(yè)合成氨是一個(gè)放熱反應(yīng)�,因此低溫有利于提高原料的轉(zhuǎn)化率���,但實(shí)際生產(chǎn)中卻采用400~500℃的高溫���,其原因是
催化活性最強(qiáng),增加反應(yīng)速率��,縮短達(dá)到平衡的時(shí)間
催化活性最強(qiáng)���,增加反應(yīng)速率�����,縮短達(dá)到平衡的時(shí)間
;工業(yè)生產(chǎn)中���,以氨氣為原料合成硝酸�,寫出工業(yè)生產(chǎn)硝酸的最后一步的化學(xué)方程式3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
.
(2)甲���、乙����、丙三個(gè)化肥廠生產(chǎn)尿素所用的原料不同,但生產(chǎn)流程相同:
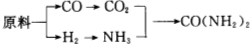
已知:CO+H2OCO2+H2
①甲廠以焦炭和水為原料�����;
②乙廠以天然氣和水為原料�����;
③丙廠以石腦油(主要成分為C5H12)和水為原料.
按工業(yè)有關(guān)規(guī)定��,利用原料所制得的原料氣H2和CO2的物質(zhì)的量之比����,若最接近合成尿素的原料氣NH3(換算成H2的物質(zhì)的量)和CO2的物質(zhì)的量之比,則對(duì)原料的利用率最高.據(jù)此判斷甲、乙��、丙三個(gè)工廠哪個(gè)工廠對(duì)原料的利用率最高�?丙
丙
.
(3)將工廠廢氣中產(chǎn)生的SO2通過(guò)下列流程如圖1����,可以轉(zhuǎn)化為有應(yīng)用價(jià)值的硫酸鈣等.
①寫出反應(yīng)Ⅰ的化學(xué)方程式:2CaCO3+O2+2SO2=2CaSO4+2CO2
2CaCO3+O2+2SO2=2CaSO4+2CO2
.
②生產(chǎn)中��,向反應(yīng)Ⅱ的溶液中加入強(qiáng)還原性的對(duì)苯二酚等物質(zhì)��,目的是防止亞硫酸銨被氧化
防止亞硫酸銨被氧化
.
③檢驗(yàn)經(jīng)過(guò)反應(yīng)Ⅲ得到的氨態(tài)氮肥中SO42-所用試劑是鹽酸和氯化鋇(HCl和BaCl2)
鹽酸和氯化鋇(HCl和BaCl2)
.
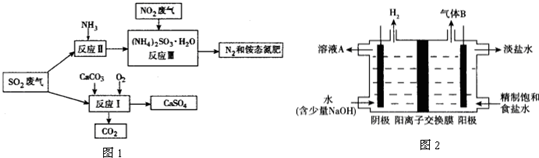
(4)工業(yè)上利用氯堿工業(yè)產(chǎn)品治理含二氧化硫的廢氣.圖2是氯堿工業(yè)中電解飽和食鹽水的原理示意圖.
①用溶液A吸收含二氧化硫的廢氣���,其反應(yīng)的離子方程式是SO2+2OH-=SO32-+H2O(或SO2+OH-=HSO3-)
SO2+2OH-=SO32-+H2O(或SO2+OH-=HSO3-)
.
②用含氣體B的陽(yáng)極區(qū)溶液吸收含二氧化硫的廢氣��,其反應(yīng)的離子方程式是SO2+Cl2+H2O=4H++SO42-+2Cl-
SO2+Cl2+H2O=4H++SO42-+2Cl-
.


